干细胞是一种珍贵的生命资源,在医疗研究领域有着巨大的前景。随着生命科学领域的技术进步和人们健康意识的觉醒,越来越多的人对干细胞技术寄予厚望。以干细胞治疗为核心的再生医学,将成为继药物治疗、
手术治疗后的另一种疾病治疗途径,是未来医学的发展方向之一。
以干细胞(Stem Cell)作为关键词搜索,截至2016年6月30日,全球在美国国立健康研究院(www.clinicaltrials.gov)已经登记注册的干细胞临床试验超过5800多个,涉及140多种不同的疾病,10年期间临床研究数目增长超过600%。
随着社会的发展,人类对干细胞及相关产品的安全性、有效性、可控性方面的需求日益迫切,以临床应用为目标的干细胞基础与转化研究已经成为新的研究热点。无论是全球还是中国,干细胞应用的市场增速和前景都相当可观。
然而虽然再生医学和干细胞治疗技术炙手可热,但是新技术在促进生产力进步的同时,总会带来社会生活的深刻变革。如何使用合理的政策法规引导和管理,既给予新技术良性发展的空间,又避免野蛮生长带来的乱象,始终在考验着各国政府和监管部门的智慧。
美国干细胞监管政策
【最新资讯】6月14日,德克萨斯州州长Greg Abbott签署了一项法案,允许该州的诊所和公司使用未经FDA审批的干细胞治疗,这意味着患者有权利自行选择是否接受干细胞治疗手段。

德克萨斯州州长Greg Abbott
这项法案将于9月1日生效。法案规定,在医生考虑其他疗法后仍推荐干细胞治疗的情况下,并且在医院或医学院机构审查委员会(IRB)监督管理下,严重慢性或绝症患者可选择在诊所中接受干细胞治疗——从成人组织如患者自身脂肪中分离出治疗所用的干细胞。值得注意的是,法案仍要求疗法已经在人类临床试验中进行测试。
美国近几年对待干细胞治疗的政策可分为联邦政府和地方政府两种。联邦政府自 2009 年 3月,美国总统奥巴马宣布解禁联邦政府资助干细胞研究后,对待干细胞的态度开始回温。
尽管形势利好,但还是少不了波折。2010年 8月 23 日美国哥伦比亚特区地方法RoyceC.Lamberth 法官在一项涉及干细胞研究的诉讼判决中,以破坏人类胚胎为由发布临时禁令,禁止联邦资金资助人类胚胎干细胞研究。
之后哥伦比亚特区巡回上诉法院立刻作出回应,裁定撤销Royce C.Lamberth 颁布的临时禁令,允许美国国家卫生研究院(National Institutes of Health,NIH)在上诉法院做出最终裁决前继续资助人类胚胎干细胞研究。随后NIH 表示 2011 财年将分别投入 3.58亿和 1.26 亿美元用于人类非胚胎干细胞和人胚胎干细胞研究。
不同于联邦政府的摇摆态度,美国各州纷纷通过地方立法的形式鼓励干细胞事业的发展。作为美国第一个通过民众公决来支持干细胞研究的州,加州民众于 2004 年11月全民投票通过加州第 71 号提案《加州干细胞研究和治疗法案》,授权加州政府在未来十年内可通过发行公债的形式筹集 30 亿美元资金用于资助干细胞研究,并且加州政府于 2005 年初专门设立“加州再生医学研究所”来负责资金的管理和分配以及干细胞研究项目的组织和管理。
在监管方面,美国食品药品管理局 (Food andDrug Administration,FDA) 设有专门的评估中心和管理办公室,根据风险的等级和类别采用分级分类管理模式,以确保细胞产品的安全性和有效性。相关的干细胞治疗产品在未获得 FDA 批准用于治疗前,必须对产品标注为研究用,并且不能有任何的产品宣传。同时,要在符合伦理学的基础上由干细胞领域资深研究人员组织可行的Ⅰ、Ⅱ及Ⅲ期临床试验,以确保用于细胞治疗产品的安全性和疗效。
而要作为生物制品或者药物进入医疗市场,审批过程就更为严格。相关的干细胞治疗产品在经过严格的Ⅰ、Ⅱ及Ⅲ期临床试验,并且在结果可靠的前提下还必须向 FDA 提交生物制品许可证申请 (BLA)或新药申请 (NDA),获得审批后才可进入市场。
根据药品临床试验申报 (Investigational NewDrug Application, IND) 相关规定,若在实验期间发生严重的不良反应甚至是死亡事件时必须及时向FDA 报告,FDA 有权命令任何一项存在安全隐患的临床试验暂缓进行;并且 IND 监管的所有临床试验每年都必须向 FDA 提交报告,以便 FDA 进行监察和审计。违反相关规定的个人或者单位会受到严格的民事或者刑事处罚。
欧洲干细胞监管政策
与美国不同,欧洲作为基督教的中心,对干细胞的态度比较保守,干细胞临床研究面临着较大的宗教文化阻力。奥地利、爱尔兰、波兰、挪威等天主教国家严格禁止干细胞研究,德国、意大利等则是对干细胞研究和应用进行了严格限制。
但在英国等相对开放国家的大力推动下,再加上全球干细胞应用的研究大趋势影响下,欧洲干细胞临床应用的研究逐渐开放。

Europe approves Holoclar®,
the first stem cell—based medicinal product
值得一提的是, 2011 年,英国药品监管部批准先进细胞技术公司进行相关胚胎干细胞试验,此为欧洲在人类胚胎干细胞领域首次予以批准; 2013 年,干细胞研究机构 TICEBA首获欧盟标准下德国医疗操作授权。2014年12月,干细胞药品Holoclar被证实推荐给欧洲药监局,这意味着首例干细胞药物离在欧洲上市仅有“一步之遥”。
如今经过一年的酝酿,这一药物将很有可能在2017年正式上市。一旦成功上市,它将带来巨大的示范效应,加速其他干细胞产品的上市申请速度,从而将2017年变成干细胞药物集中上市的“大年”。
欧洲药监局以及欧盟议会在相关干细胞治疗的研究过程中起到了主导作用,通过指定相应的规章制度来指导规范干细胞领域的发展。
早在 2007 年,欧盟议会就通过决议,将细胞疗法作为一种医疗产品进行细胞层面上的操作,但应用这些细胞的预期结果与在人体内的一般功能也不尽相同,认为凡涉及到细胞治疗的产品必须要获得相应部门的审批授权并严格控制。在欧洲,对于来源于干细胞相关研究操作药品的控制以及安全性问题,由先进治疗药用产品(ATMP)立法来进行相应规范指导与紧密控制。
可以看到,现今欧洲各国尽管面临宗教压力,但也不难看出基于相应法规的控制指导下其干细胞领域的迅猛发展。
此外,在全球经济持续疲软的情况下,精准医疗有望成为下一代科技革命爆发的关键领域之一,成为新的经济增长动力。随着以美国为代表的医疗研究力量的不断发展,欧洲逐渐开始感受到来自国际的科研发展压力,因此,欧洲也很可能在2017年里进一步加大对以精准医疗、干细胞临床应用为代表的高端生物医药研发与制造的投入,以保证自己在这场新的生物技术革命中“不掉队”。
韩日干细胞监管政策
纵观亚洲国家,韩国曾一度成为干细胞强国,但如今被发达国家和新兴国家紧紧夹在中间。
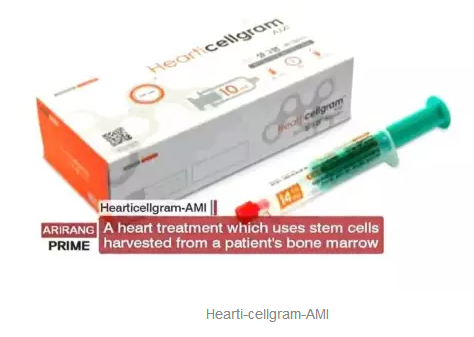
2011年,韩国食品药品监管局获准FCB-Pharmicell公司研发的心脏病治疗药物Hearti-cellgram-AMI投入市场销售,心脏病治疗药物 Hearti-cellgram-AMI的投入销售标志着全球首个干细胞药物在韩国上市,也意味着韩国向重新恢复干细胞研究领域的领先地位迈进了一步。
同年,韩国政府宣布将在 2012 年投入超过1000 亿韩元以推动支持韩国在干细胞临床研究领域的发展,这些资金集中用于临床试验、干细胞治疗的安全性、干细胞研究的核心技术,以及干细胞领域相关人才的培养。
2012 年,韩国食品药品监管局批准Medi-post公司研发的软骨再生治疗药物 Cartistem 的生产许可以及 Anterogen 公司研发的关于肛瘘治疗药物Cuepistem 的生产审批许可。

